孔德新教授课题组近期在《Advanced Science》(IF=17.521)杂志上发表题为“Stellettin B sensitizes glioblastoma to DNA-damaging treatments by suppressing PI3K-mediated homologous recombination repair”的文章,报道了海洋来源Stellettin B(STELB)通过靶向PI3K介导的同源重组修复而增敏针对胶质母细胞瘤(GBM)的DNA损伤疗法。我校博士后彭鑫为该论文的第一作者。通讯作者为孔德新教授、上海交通大学林厚文教授、美国MD Anderson Cancer Center的Han Liang教授以及我院王冉副教授。
GBM是恶性程度最高的颅内肿瘤之一,缺乏有效的靶向药物,患者预后差。目前临床上针对GBM的一线治疗策略主要包括基于电离辐射(IR)的放疗和基于替莫唑胺(TMZ)的化疗。由于GBM在细胞和分子层面存在的高度异质性,患者的实际受益并不理想,因此寻找和开发新型药物及有效联合策略是提高GBM治疗成功率的重要手段,也是解决重要临床需求的关键。
该研究利用基于电离辐射的DNA损伤表型筛选结合一系列DNA损伤相关生物学实验发现STELB具有放疗增敏作用,同时发现STELB与TMZ在对多种GBM细胞株的增殖抑制活性实验中均表现出显著的协同作用。利用基于RNA-Seq的生物信息学分析结合蛋白泛素化相关生物学实验发现,STELB可通过增加PI3K的泛素化,从而抑制PI3K介导的同源重组修复发挥放化疗增敏作用。利用U87裸鼠皮下移植瘤模型、斑马鱼和裸鼠原位移植瘤模型评价其抗肿瘤效果发现,STELB具有显著的抗胶质母细胞瘤效果,且能够显著增敏TMZ的抗肿瘤作用。令人兴奋的是,体内药物动力学实验提示STELB具有快速通过血脑屏障的潜力,为后续STELB的进一步开发打下了坚实的基础。
该研究得到国家自然科学基金国际合作研究项目、面上项目、青年项目,中国博士后基金会面上项目以及天津市新药创制科技重大专项等基金的支持。
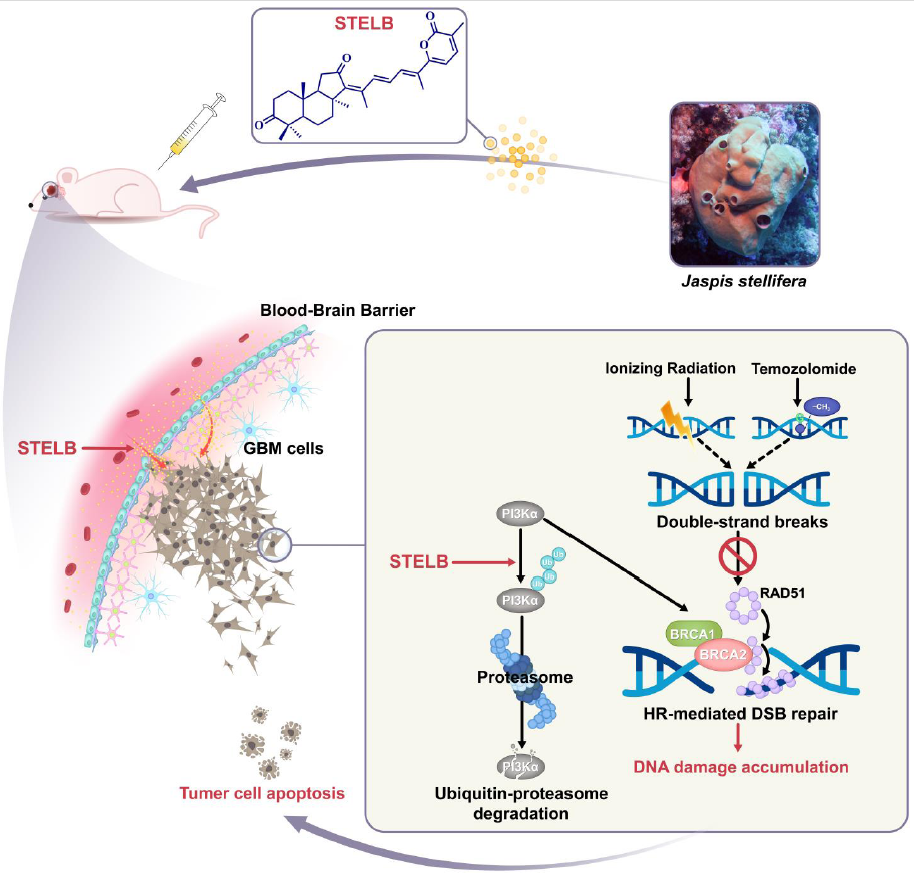
图1. 海绵来源的STELB抗胶质母细胞瘤及增敏TMZ和放疗的作用机制

