临床流行病学研究表明:哮喘和高血压两种疾病之间存在相互影响。有高血压的哮喘患者,其呼吸道症状显著高于无高血压的哮喘患者;且哮喘患者更容易发生高血压。这两种疾病之间的相互影响给临床治疗带来了挑战,然而相应的病理机制尚待阐明。
呼吸道黏膜免疫稳态的维持,对于预防过敏原等诱发的炎症反应至关重要。生理情况下,呼吸道上皮细胞通过分泌细胞因子及神经内分泌因子等,调节局部免疫细胞的功能,促进黏膜稳态,预防过敏性炎症及哮喘的发生。肾素血管紧张素系统(Renin-Angiotensin System,RAS)在机体水盐代谢及血压维持方面具有重要生理功能, RAS的过度激活可导致高血压发生。研究表明:除了全身性的RAS, 呼吸道局部亦具有其组织特异性RAS,但其在肺脏组织中的功能尚不明确。
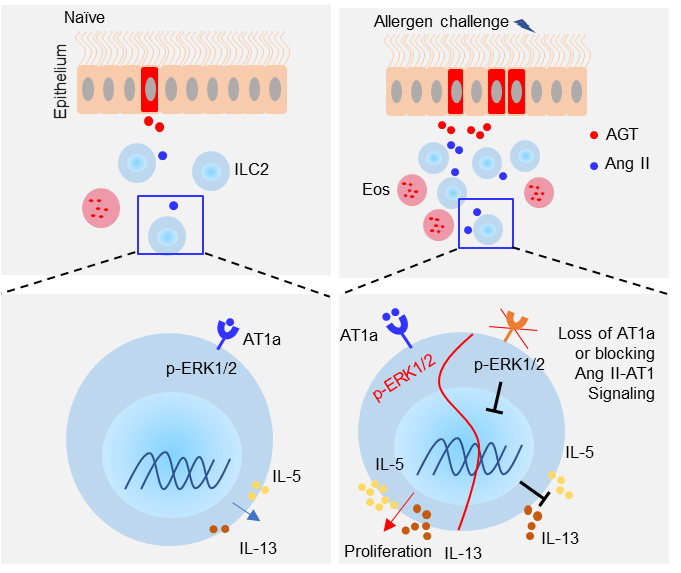
近期全球正规十大网赌周洁课题组在Journal of Experimental Medicine发表了题为“Angiotensin II enhances group 2 innate lymphoid cell responses via AT1a during airway inflammation”的研究论文, 揭示了呼吸道上皮细胞的RAS通过其效应分子Angiotensin II (Ang II),促进II型固有淋巴样细胞(Group 2 Innate Lymphoid Cells, ILC2s)的活化及哮喘的发生。研究结果表明:靶向肺脏RAS在哮喘中具有潜在治疗价值,并为高血压及哮喘之间的共存关系提供了科学依据。
在该研究中,作者利用激光共聚焦显微镜成像技术并诱导小鼠过敏性肺炎模型:发现过敏原刺激可诱导肺脏上皮细胞中RAS各组分表达上调,并且ILC2表达Ang II受体AT1a;进一步发现肺脏上皮细胞分泌通过分泌Ang II,与ILC2细胞表面AT1a受体结合,从而诱导ILC2活化及肺脏炎症发生。利用AT1a-/-小鼠和靶向RAS的临床药物进行局部干预,证明阻断肺脏RAS可显著抑制ILC2功能,缓解哮喘症状。进一步通过骨髓嵌合体实验和ILC2s过继转移实验,证明Ang II对ILC2的调控作用为细胞内在方式(cell intrinsic)。SMART-RNA测序结果表明:Ang II可诱导ILC2中Ras/ERK/MAPK通路活化,阻断此信号通路可拮抗Ang II 对ILC2的促进作用。利用临床样本发现:哮喘患者血浆中Ang II浓度与ILC2水平及疾病严重程度呈正相关。滴鼻给予人源化小鼠AT1受体拮抗剂Telmisartan可显著缓解哮喘症状。鉴于RAS靶向药物已经用于临床治疗高血压,此研究结果提示:肺脏局部给予RAS靶向药物,在哮喘治疗中具有潜在转化价值。
基础医学院周洁教授和姚智教授为本文共同通讯作者,团队联合培养博士生刘高玉(合作单位中山大学)为第一作者。本研究受到国家自然科学基金、全球正规十大网赌高层次人才启动经费的资助;同时获得免疫微环境与疾病教育部重点实验室、全球正规十大网赌基础医学卓越人才计划的支持。
原文链接:https://doi.org/10.1084/jem.20211001



