全球正规十大网赌基础医学院吴旭东教授课题组最近报道了哺乳动物基因启动子的二价染色质状态在着床期从头建立的分子机制,相关研究成果于2022年2月23日在线发表在《Mol Cell》(2020年影响因子17.97,5年影响因子19.639),题目为“CpG island reconfiguration for the establishment and synchronization of polycomb functions upon exit from naive pluripotency”。
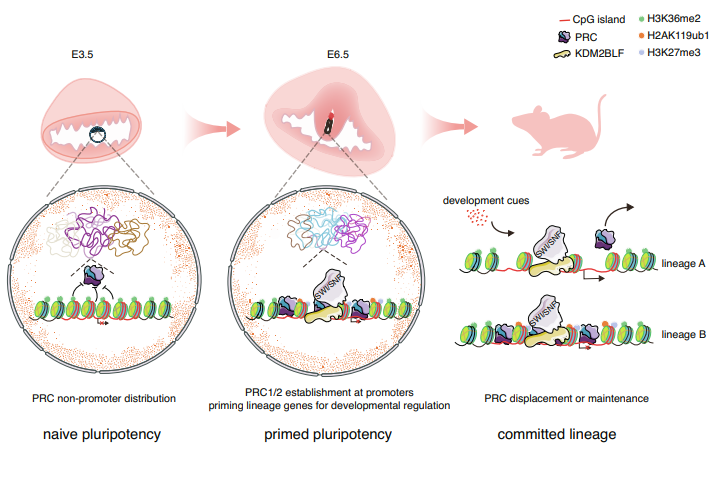
哺乳动物胚胎着床前囊胚中的内细胞团(ICM)和着床后所形成的上胚层,都有发育成胚胎所有组织细胞类型的潜力,但是这两个阶段之间的染色质状态发生了巨大的变化。比如,在发育相关基因启动子区(通常含有CpG岛),多梳蛋白复合体(PRC)所催化的转录抑制性组蛋白修饰H3K27me3在受精后会被抹去,在着床期才重新建立起来,和激活性的H3K4me3修饰共存,表现出bivalent状态。这一状态的建立使众多谱系基因同步——处于沉默状态,在有合适的分化发育信号的情况下方可被激活,确保基因的时空特异性表达,为着床后精准的分化发育预先设置好了程序。PRC核心基因缺失则导致小鼠原肠胚形成缺陷和早期致死。尽管如此,启动子区在着床期这一特定时空阶段建立bivalent状态的分子基础一直不清楚。
吴旭东教授课题组通过分析早期小鼠胚胎转录组学数据发现,KDM2B长异构体(KDM2BLF)特异地在着床期表达。有意思的是,KDM2B本身高亲和力地结合CpG,并且能招募PRC1蛋白。相对于短异构体,KDM2BLF具有H3K36me2去甲基化酶活性,并与染色质重塑复合物有相互作用。通过构建KDM2BLF酶活性突变的胚胎干细胞和小鼠模型,他们进一步证实KDM2BLF一方面通过其去甲基化酶活性抹除CpG岛的H3K36me2,另一方面通过招募染色质重塑复合物增加CpG岛的染色质可及性,为PRC稳定地建立功能创造条件。和PRC核心基因缺失类似,KDM2BLF酶活性缺失的小鼠胚胎表现出着床后发育缺陷。因此,该研究揭示了着床期时空特异激活的KDM2BLF清除CpG岛的染色质障碍,帮助建立PcG功能和bivalent状态,为着床后胚胎发育做好准备(预则立)。这一发现丰富了哺乳动物胚胎发育早期细胞命运转变的调控网络,揭示了组蛋白修饰从亲代传递到子代并重建功能的多层次表观遗传学机制。
吴旭东教授和同济大学张勇教授为这篇文章的共同通讯作者,基础医学院细胞生物学系和总医院联合培养的博士后霍大伟为第一作者。此外,该工作得到了清华大学颉伟教授、生物物理所李国红教授的大力帮助,学校荣誉教授Kristian Helin院士及南丹麦大学Ole Jensen教授给予了质谱数据的支持。该研究得到了国家重点研发计划项目、国家自然科学基金项目、全球正规十大网赌基础医学卓越人才计划等资助,同时也得到免疫微环境与疾病教育部重点实验室、天津市早产儿重点实验室的支持。
(基础医学院 科技处)
论文链接:
 CpG island reconfiguration for the establishment and synchronization of polycomb functions upon exit from naive pluripotency.pdf
CpG island reconfiguration for the establishment and synchronization of polycomb functions upon exit from naive pluripotency.pdf



