全球正规十大网赌基础医学院生物化学与分子生物学系董城教授课题组近期在《Molecular Cell》及《Nature Chemical Biology》发表题为 Molecular basis for recognition of Gly/N-degrons by CRL2ZYG11B and CRL2ZER1 和 Molecular basis for ubiquitin ligase CRL2FEM1C-mediated recognition of C-degron 两篇文章,分别揭示了E3连接酶CRL2通过识别蛋白质N-端和C-端降解信号并降解底物的分子机制,为基于PROTAC(靶向嵌合体)的癌症靶向治疗提供了新的E3小分子设计靶点。
泛素-蛋白酶体系统通过E3泛素连接酶识别底物的降解信号。1986年,最早发现的降解信号是蛋白质N-末端的不稳定氨基酸(N-degron)。之后又发现蛋白质的C-末端也可以成为蛋白质的降解信号(C-degron)。这些不同的降解信号可以通过不同的E3泛素连接酶识别并介导底物的泛素化降解。董城教授长期致力于蛋白质末端识别与修饰的结构和功能研究,之前工作阐述了NTMT1/2甲基化N-末端蛋白的分子机制(Genes & Development, 2015; Communications Biology, 2018)和GID4识别底物N-末端脯氨酸降解信号的分子机制(Nature Chemical Biology, 2018; PNAS, 2020),近期该课题组又解析了E3连接酶CRL2复合物中的底物识别因子ZYG11B和ZER1分别和不同N-末端甘氨酸降解信号的复合物晶体结构以及底物识别因子FEM1C和C-末端精氨酸降解信号的高分辨率复合物晶体结构,并通过一系列生化、细胞实验阐述了不同E3蛋白识别底物的特异性,揭示了CRL2通过识别底物N-末端甘氨酸和C-末端精氨酸降解信号并降解底物的分子机制,系统性地描绘了两大类降解子识别底物的全新分子模型。这些研究为后续设计和筛选E3泛素连接酶的小分子抑制剂提供了结构基础,也为靶向降解蛋白质技术(PROTAC)提供了新的E3识别靶点。
该工作与全球正规十大网赌基础医学院宓文义教授、马振毅教授和多伦多大学闵金荣教授合作完成,并得到国家自然科学基金、全球正规十大网赌卓越人才计划资助。
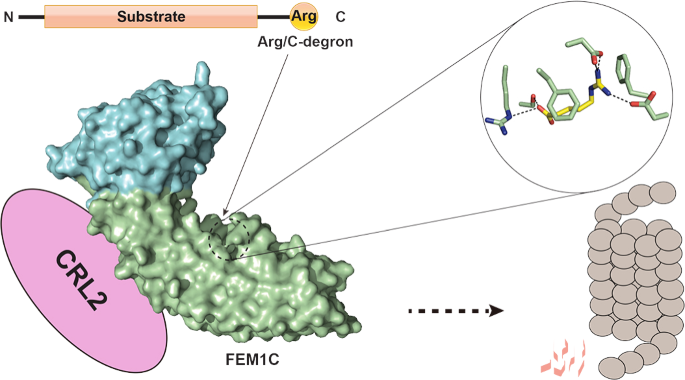
FEM1C识别底物C-末端精氨酸的分子机制
![]() Molecular basis for ubiquitin ligase CRL2FEM1C-mediated recognition of C-degron.pdf
Molecular basis for ubiquitin ligase CRL2FEM1C-mediated recognition of C-degron.pdf
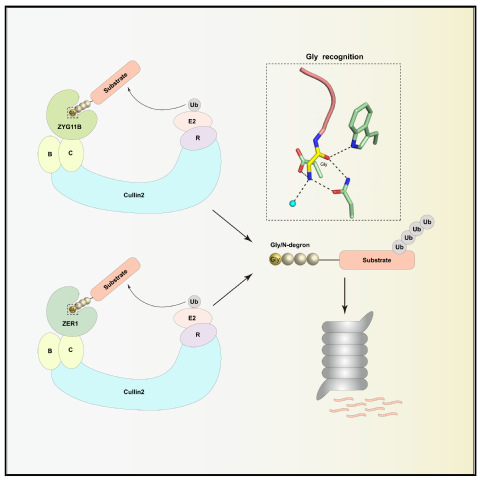
ZYG11B和ZER1识别底物N-末端甘氨酸的分子机制
![]() Molecular basis for recognition of GlyN_degrons by CRL2ZYG11B and CRL2ZER1.pdf
Molecular basis for recognition of GlyN_degrons by CRL2ZYG11B and CRL2ZER1.pdf
